Lipozomální technologie
Liposomální technologie využívá nanotechnologie ve formě lipozomů, jejichž stavební bloky, fosfolipidy, se přirozeně vyskytují v našich buněčných membránách. Liposomy jsou lipidové vezikuly (vezikula - je název pro strukturu uvnitř nebo vně buňky a ohraničenou lipidovou 2-vrstvou), do kterých lze zapouzdřit aktivní složky a chránit je tak před nepříznivým prostředím trávicího traktu. Takto se aktivní složky přenášejí přímo do krve.
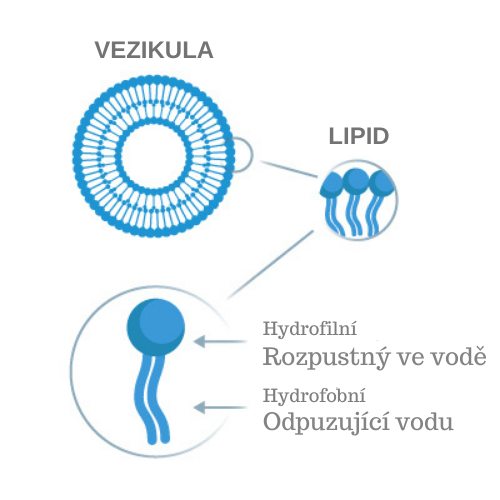
Co jsou liposomy?
Slovo lipozom je odvozeno z řeckého termínu „lipos“ (tuk) a „soma“ (tělo).
Liposomy jsou lipidové vezikuly, které se skládají ze dvou vrstev těsně uspořádaných fosfolipidů, tvořících dvojitou membránu. Takovou dvojitou membránu najdeme téměř ve všech biomembránách (např. v buněčných membránách našeho těla). Liposomy jsou schopny transportovat různé látky, bez ohledu na jejich náboj, velikost nebo strukturu a zároveň je chránit před trávicími enzymy v těle a do jisté míry i před žaludeční kyselinou. Transport těchto látek může probíhat ve vodním jádru liposomu nebo v tucích rozpustné dvojité membráně, v závislosti na tom, zda se jedná o hydrofilní nebo hydrofobní látku, kterou liposom přepravuje.
Hlavními stavebními jednotkami liposomů jsou fosfolipidy. Fosfolipidy jsou převážně rostlinného původu, např. ze slunečnice. Liposomy mohou teoreticky splývat is buněčnými membránami, protože struktura dvojité fosfolipidové membrány je stejná jako struktura našich hlavních stavebních bloků. Díky této skutečnosti je absorpce fosfolipidových membrán a jejich příjem v těle prioritou. Takto se lipozomy snadno dostanou do cíle přes trávicí trakt, nesouce s sebou aktivní složku, kterou může být například vitamin C, b-komplex, kyselina hyaluronová, nebo kolagen...
Liposomy mají tři základní vlastnosti:
Slovo lipozom je odvozeno z řeckého termínu „lipos“ (tuk) a „soma“ (tělo).
Liposomy jsou lipidové vezikuly, které se skládají ze dvou vrstev těsně uspořádaných fosfolipidů, tvořících dvojitou membránu. Takovou dvojitou membránu najdeme téměř ve všech biomembránách (např. v buněčných membránách našeho těla). Liposomy jsou schopny transportovat různé látky, bez ohledu na jejich náboj, velikost nebo strukturu a zároveň je chránit před trávicími enzymy v těle a do jisté míry i před žaludeční kyselinou. Transport těchto látek může probíhat ve vodním jádru liposomu nebo v tucích rozpustné dvojité membráně, v závislosti na tom, zda se jedná o hydrofilní nebo hydrofobní látku, kterou liposom přepravuje.
Hlavními stavebními jednotkami liposomů jsou fosfolipidy. Fosfolipidy jsou převážně rostlinného původu, např. ze slunečnice. Liposomy mohou teoreticky splývat is buněčnými membránami, protože struktura dvojité fosfolipidové membrány je stejná jako struktura našich hlavních stavebních bloků. Díky této skutečnosti je absorpce fosfolipidových membrán a jejich příjem v těle prioritou. Takto se lipozomy snadno dostanou do cíle přes trávicí trakt, nesouce s sebou aktivní složku, kterou může být například vitamin C, b-komplex, kyselina hyaluronová, nebo kolagen...
Liposomy mají tři základní vlastnosti:
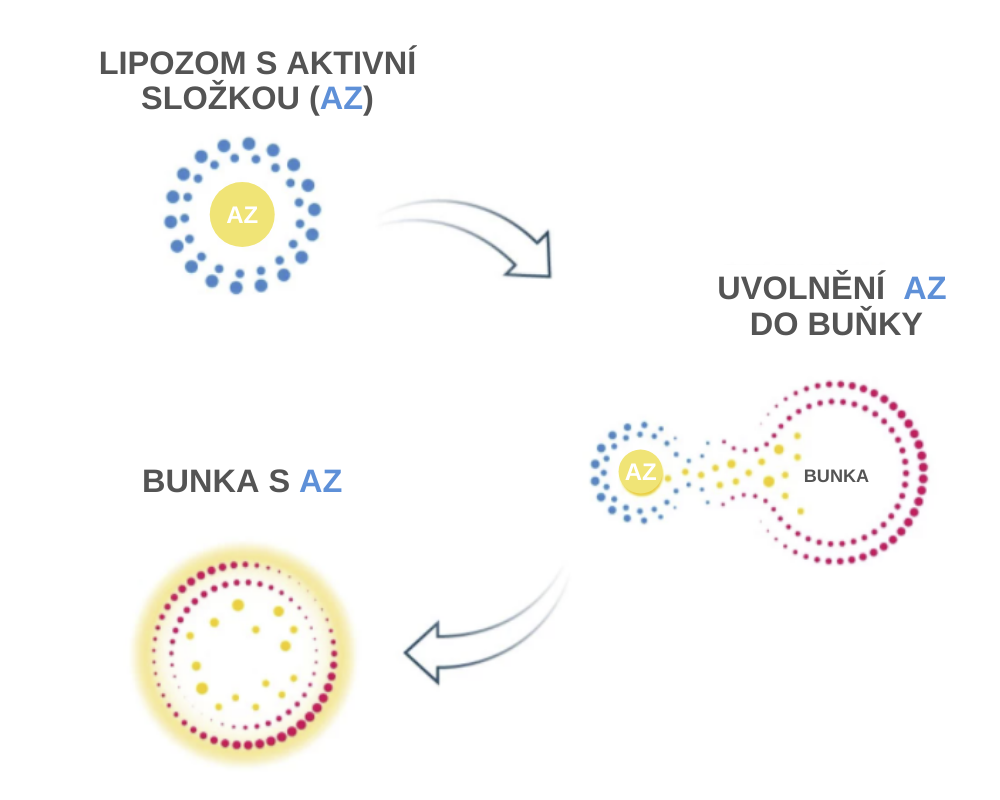
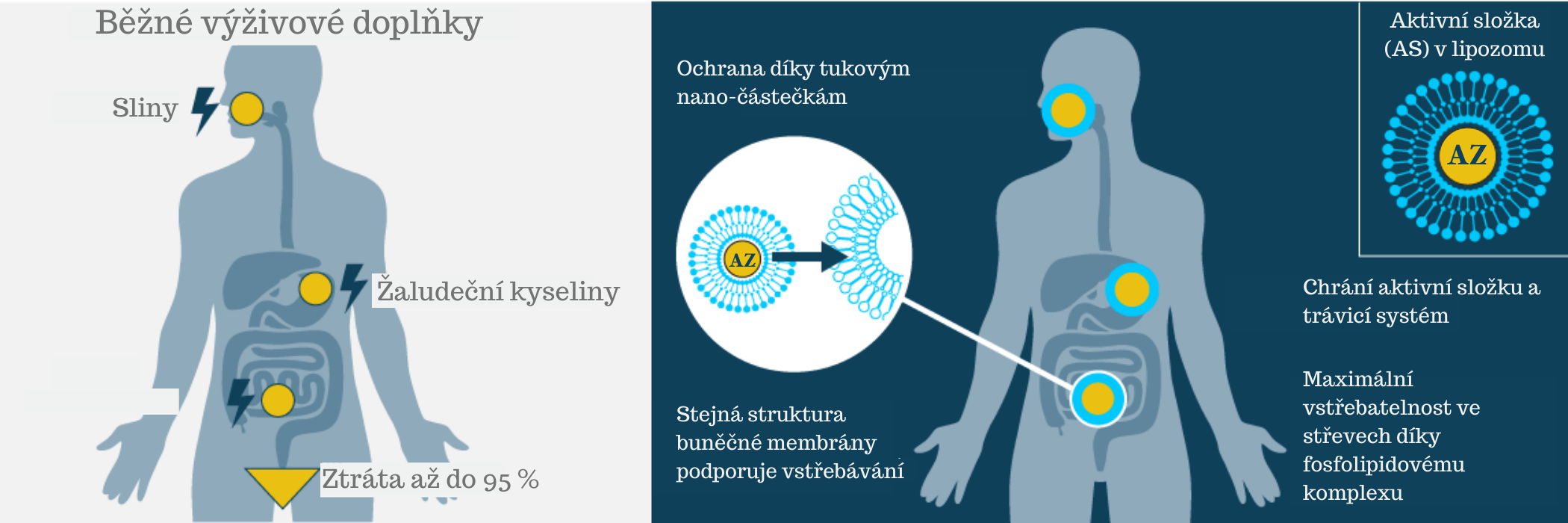
Chrání aktivní složku: Prostředí žaludku může poškodit některé aktivní složky. Aktivní složky zapouzdřené v lipozomech jsou v zažívacím systému chráněny.
Maskování: Fosfolipidy maskují aktivní složky a tak se mohou absorbovat jejich větší množství. Uniknou tak selektivní funkci tenkého střeva. Osmotické (hydrofilní) vedlejší účinky způsobené vysokými dávkami některých vitamínů a minerálů se tak dají snížit.
Absorpce: Liposomy se přednostně vstřebávají střevní stěnou, protože stejně jako naše buněčné membrány sestávají z fosfolipidů. Účinné látky pak normální absorpcí tuků vstupují přímo do enterocytů (střevních buněk) a odtud přes lymfatický systém přímo do krve. Je tak možné se vyhnout cestě přes játra a zvýšit tak biologickou dostupnost aktivní složky [*].
Maskování: Fosfolipidy maskují aktivní složky a tak se mohou absorbovat jejich větší množství. Uniknou tak selektivní funkci tenkého střeva. Osmotické (hydrofilní) vedlejší účinky způsobené vysokými dávkami některých vitamínů a minerálů se tak dají snížit.
Absorpce: Liposomy se přednostně vstřebávají střevní stěnou, protože stejně jako naše buněčné membrány sestávají z fosfolipidů. Účinné látky pak normální absorpcí tuků vstupují přímo do enterocytů (střevních buněk) a odtud přes lymfatický systém přímo do krve. Je tak možné se vyhnout cestě přes játra a zvýšit tak biologickou dostupnost aktivní složky [*].
Co znamená „lipozomální“?
Fosfolipidy jsou za určitých podmínek schopny zachytit kapalinu v lipidové bublině. To, zda tato kapalina obsahuje vitamíny, minerály nebo mikroživiny, je pro lipozom nepodstatné. Během fáze formování jsou tak esenciální látky ve vodných roztocích automaticky uzavřeny v lipozomech. Potraviny obohacené o lipozomy se nazývají „lipozomální“, pokud je primární účinná látka obsažená v potravině uzavřena v lipozomech. Zaručen je tak snazší transport vitamínů, minerálů a mikroživin (aktivních látek) do krve přes slizniční a střevní epiteliální buňky.
Fosfolipidy jsou za určitých podmínek schopny zachytit kapalinu v lipidové bublině. To, zda tato kapalina obsahuje vitamíny, minerály nebo mikroživiny, je pro lipozom nepodstatné. Během fáze formování jsou tak esenciální látky ve vodných roztocích automaticky uzavřeny v lipozomech. Potraviny obohacené o lipozomy se nazývají „lipozomální“, pokud je primární účinná látka obsažená v potravině uzavřena v lipozomech. Zaručen je tak snazší transport vitamínů, minerálů a mikroživin (aktivních látek) do krve přes slizniční a střevní epiteliální buňky.
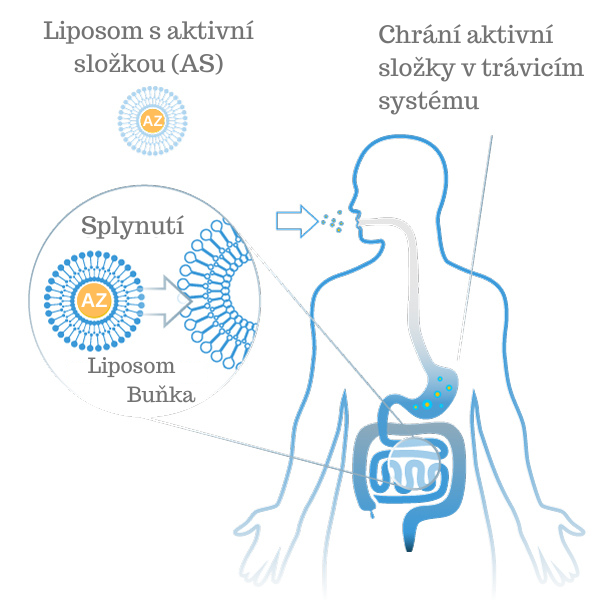
Tento transport aktivních látek přímo do krve je možný díky tomu, že lipozomy jsou amfifilní látky (rozpustné ve vodě a v tucích - část molekuly je polární (hydrofilní) a část molekuly složeného lipidu je nepolární (hydrofobní)). Znamená to téměř úplné dodání aktivní látky do krve. Díky této optimalizované absorpci lze významně zvýšit biologickou dostupnost a maximalizovat tak účinek aktivní látky. To má smysl například tehdy, pokud se užívají obtížně vstřebatelné účinné látky, jako jsou kurkumin, hořčík nebo vitamin C, nebo pokud se aktivní látky užívají ve vysokých dávkách. V případě běžných výživových doplňků je při perorálním podání aktivní látky (užití např. kapslí či sirupů ústy) více než 75 % všech aktivních látek ovlivněno narušením biologické dostupnosti, někdy až tak drasticky, že do krve se podaří transportovat pouze několik procent aktivní látky. Pokud tedy vitamín, minerál, rostlinná nebo endogenní látka nese přívlastek „lipozomální“, znamená to, že byla použita lipozomální technologie. Aktivní látka je chráněna ve dvojité membráně fosfolipidů a je transportována přímo do krve.
Proč upřednostnit lipozomální produkty?
Problém běžných doplňků stravy spočívá v jejich podstatě. Cílem podání aktivní látky jsou buňky tkání a ty jsou dostupné přes krevní oběh. Teoreticky, intravenózně (aplikování do žíly – injekce nebo infuze) podávání aktivní látky představuje nejrychlejší transport na místo jejího účinku. Avšak díky tomu, že tato metoda je relativně komplikovaná a také díky oprávněné obavě ze zvýšeného rizika zavedení infekce při aplikaci kanyly (jehly), zvolí se perorální podávání aktivní látky. Je to v podstatě nejběžnější praxe. Perorálně podávané běžné doplňky stravy jsou první a zatím často jedinou volbou, pokud jde o přísun důležitých látek.
Problém běžných doplňků stravy spočívá v jejich podstatě. Cílem podání aktivní látky jsou buňky tkání a ty jsou dostupné přes krevní oběh. Teoreticky, intravenózně (aplikování do žíly – injekce nebo infuze) podávání aktivní látky představuje nejrychlejší transport na místo jejího účinku. Avšak díky tomu, že tato metoda je relativně komplikovaná a také díky oprávněné obavě ze zvýšeného rizika zavedení infekce při aplikaci kanyly (jehly), zvolí se perorální podávání aktivní látky. Je to v podstatě nejběžnější praxe. Perorálně podávané běžné doplňky stravy jsou první a zatím často jedinou volbou, pokud jde o přísun důležitých látek.
Neefektivnost běžných výživových doplňků dlouhodobě poškozuje jejich reputaci. Teoretické účinky založené na studiích „in vitro“ v mnoha případech kontrastují s praktickou neúčinností „in vivo“. Některé citlivé účinné látky mohou ztratit významnou část svých vlastností při průchodu trávicí soustavou, nebo se jednoduše neabsorbují v tenkém střevě. Jsou-li molekulární aglomerace příliš velké, mají příliš malou rozpustnost ve vodě na to, aby se absorbovaly, nebo jsou příliš hydrofobní na to, aby se mohly rozpustit, mohou pouze okrajově procházet střevní stěnou a neplní tak svoji funkci. Většina z nich se nevyužitá vyloučí přes střevo nebo ledviny.
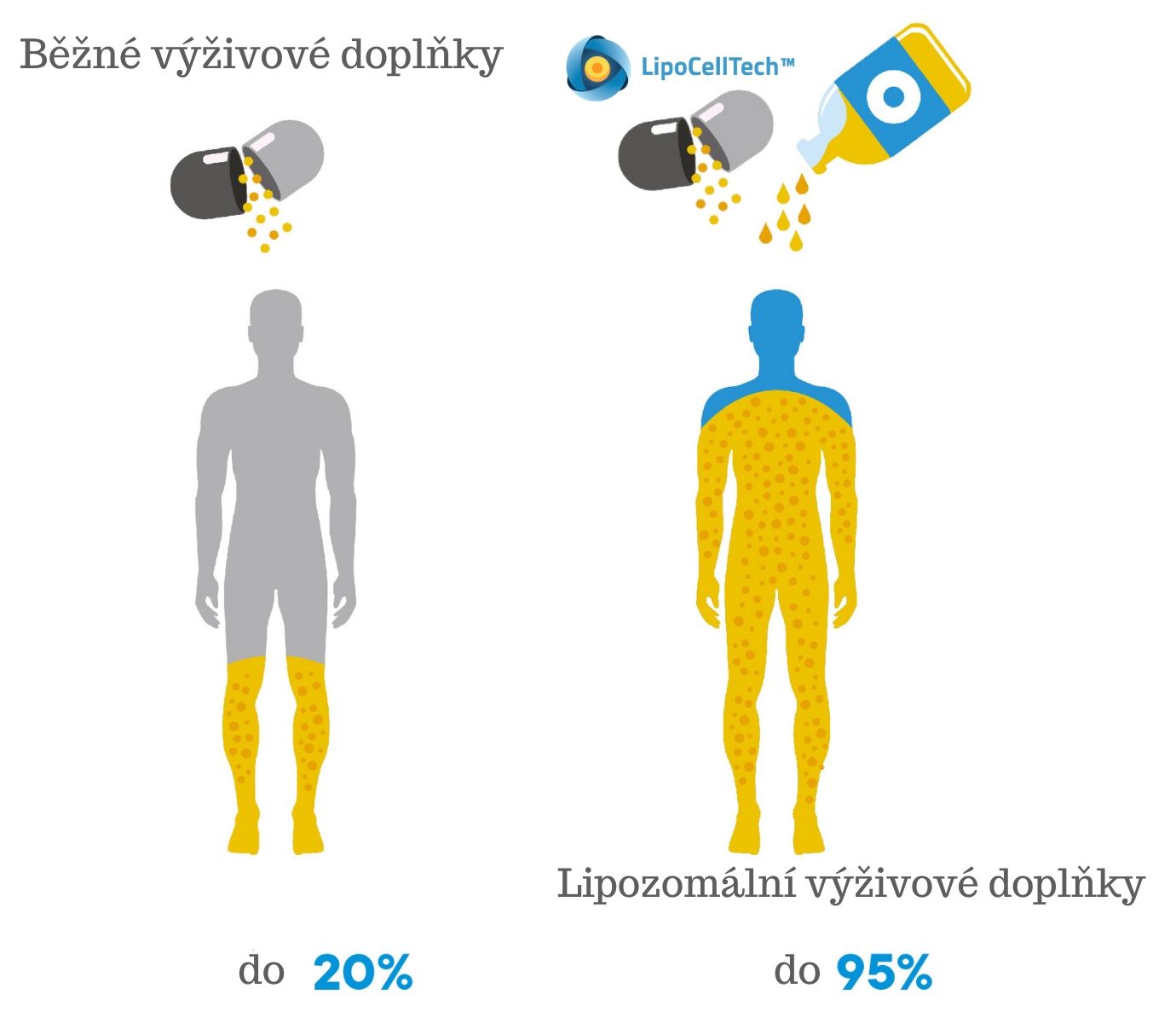
Vědci zjistili, že lipozomální formulace lze použít k ochraně a transportu terapeutických látek, jako jsou léky, ale také výživných látek a jiných důležitých složek. Liposomy se ve farmaceutickém průmyslu používají již desetiletí pod klíčovým slovem „drug targeting“. Jedná se o efektivní využití aktivní látky díky vysoké biologické dostupnosti a zacílení. Studie ukazují, že liposomy zvyšují biologickou dostupnost aktivní látky až 46,79-krát. To je rychlost, jakou se účinná látka dostává do krevního oběhu. Z ekonomického hlediska lze tuto biologickou dostupnost porovnat s poměrem ceny a výkonu. Čím je biologická dostupnost účinné látky vyšší, tím má větší vliv na organismus. Avšak ještě důležitější, než je poměr cena a výkon je skutečnost, že mnoho aktivních látek se ve významném množství může do krve přenést jen díky lipozomům. Při užívání běžných výživových doplňků absorpci určitého množství aktivní látky nikdy nebylo možné dosáhnout.
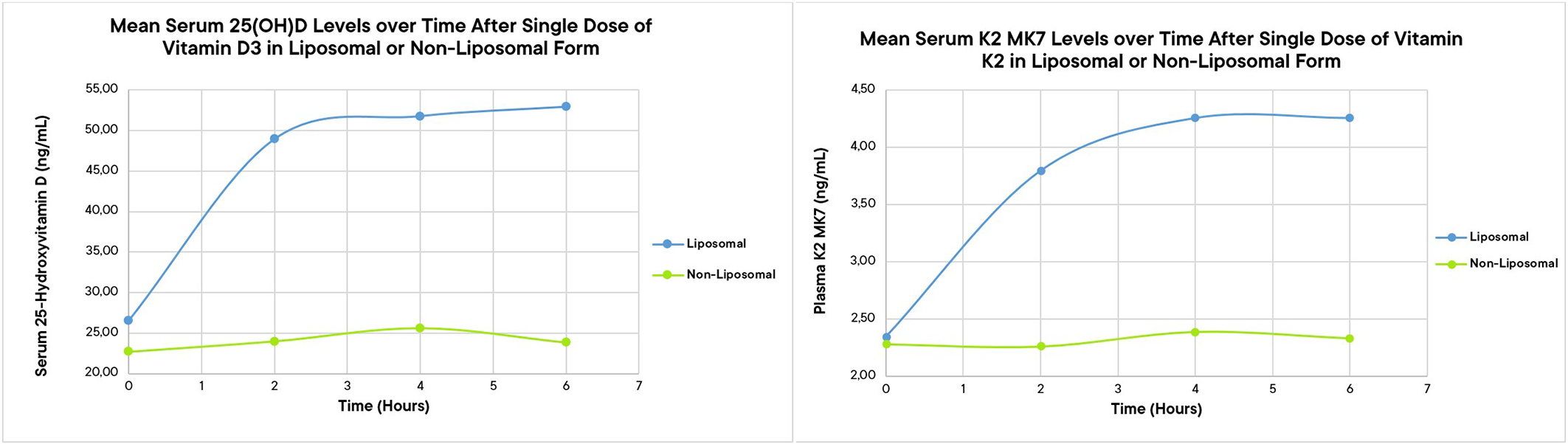
Pro srovnání: s běžnými doplňky rozpuštěnými v tucích může absorpce vitamínů kolísat v důsledku faktorů, jako jsou obsah žaludku a vlastní trávení tuků! Naše studie vitamínu D3 ukazuje, že lipozomální technologie může dosáhnout 13-krát lepší absorpce než běžné nelipozomální přípravky a je prokázáno, že zvyšuje hladinu vitamínu D v krvi během delšího časového období.
- Gregoriadis, G. [ed.] (2007) Liposome Technology. Third edition. Volume III: Interactions of Liposomes with the Biological Milieu. New York, NY: Informa Healthcare USA, Inc.
- Hickey, S., H. Roberts, and N. Miller. (2008) Pharmacokinetics of oral vitamin C. Journal of Nutritional & Environmental Medicine July 31.
- Hadavi D, Poot AA (2016) Biomaterials for the Treatment of Alzheimer’s Disease; Frontiers in Bioengineering and Biotechnology 4:49
- Hemanthkumar M, Spandana V (2011): Liposomal encapsulation technology a novel drug delivery designed for ayurvedic drug preparation; International Research Journal of Pharmacy 2(10):4-6
- Hoesel, L., M. Flierl, A. Niederbichler, D. Rittirsch, S. McClintock, J. Reuben, M. Pianko, W. Stone, H. Yang, M. Smith, J. Sarma, and P. Ward. (2008) Ability of antioxidant liposomes to prevent acute and progressive pulmonary injury. Antioxidants & Redox Signaling 10(5):973-981.
- Hyeongmin Kim, Yeongseok Kim, Jaehwi Lee (2013): Liposomal formulations for enhanced lymphatic drug delivery, Asian Journal of Pharmaceutical Sciences, Volume 8, Issue 2, Pages 96-103, ISSN 1818-0876
- Imaizumi, S., V. Woolworth, R. Fishman, and P. Chan. (1990) Liposome-entrapped superoxide dismutase reduces cerebral infarction in cerebral ischemia in rats. Stroke 21(9):1312-1317.
- Jiao Z, Wang X, Yin Y, Xia J, Mei Y. (2018) Preparation and evaluation of a chitosan-coated antioxidant liposome containing vitamin C and folic acid. J Microencapsul ;35(3):272-280. doi: 10.1080/02652048.2018.1467509. PMID: 29671362
- Jubeh, T., M. Nadler-Milbauer, Y. Barenholz, and A. Rubinstein. (2006) Local treatment of experimental colitis in the rat by negatively charged liposomes of catalase, T MN and SOD. Journal of Drug Targeting 14(3):155-163.
- Junghans, A., H. Sies, and W. Stahl. (2000) Carotenoid-containing unilamellar liposomes loaded with glutathione: a model to study hydrophobic-hydrophilic antioxidant interaction. Free Radical Research 33(6):801-808.
- Kasbo, J., B. Tuchweber, S. Perwaiz, G. Bouchard, H. Lafont, N. Domingo, F. Chanussot and I. Yousef. (2003) Phosphatidylcholine enriched diet prevents gallstone formation in mice susceptible to cholelithiasis. Journal of Lipid Research 44(12):2297-2303.
- Konno, H., A. Matin, Y. Maruo, 5. Nakamura, and S. Baba. (1996) Liposomal ATP protects the liver from injury during shock. European Surgica/·Research 28(2): 140-145.
- Korb, V., K. Tep, V. Escriou, C. Richard, D. Scherman, L. Cynober, J. Chaumeil, and G. Dumortier. (2008) Current data on ATPcontaining liposomes and potential prospects to enhance cellular energy status for hepatic applications. Critical Reviews in Therapeutic Drug Carrier Systems 25(4):305-345.
- Lamireau, T., G. Bouchard, I. Yousef, H. Clouzeau-Girard, J. Rosenbaum, A. Desmouliere and B. Tuchweber. (2007) Dietary lecithin protects against cholestatic liver disease in cholic acid-fed Abcb4- deficient mice. Pediatric Research 61(2):185-190.
- Lee, S., H. Yuk, D. Lee, K. Lee, Y. Hwang and R. Ludescher. (2002) Stabilization of retinal through incorporation into liposomes. Journal of Biochemistry and Molecular Biology 35(4) :358-363.
- Lee, S., Y. Han, B. Min, and I. Park. (2003) Cytoprotective effects of polyenoylphosphatidylcholine (PPC) on beta-cells during diabetic induction by streptozotocin. The Journal of Histochemistry and Cy tochemistry 51(8):1005-1015.
- Levy, T. (2006) Stop America’s #1 Killer. Reversible Vitamin Deficiency Found to be Origin of ALL Coronary Heart Disease. Henderson, NV: LivOn Books.
- Liang, W., D. Johnson, and S. Jarvis. (2001) Vitamin C transport systems of mammalian cells. Molecular Membrane Biology 18(1):87-95.
- Lieber, C. (2004) Alcoholic fatty liver: its pathogenesis and mechanism of progression to inflammation and fibrosis. Alcohol 34(1):9-19.
- Ling, S., E. Magosso, N. Khan, K. Yuen, and S. Barker. (2006) Enhanced oral bioavailability and intestinal lymphatic transport of a hydrophilic drug using liposomes. Drug Development and Industrial Pharmacy 32(3):335-345.
- Lubin, B., S. Shohet, and D. Nathan. (7972) Changes in fatty acid metabolism after erythrocyte peroxidation: stimulation of a membrane repair process. The Journal of Clinical Investigation 51(2):338-344.
- Maheshwari, H., R. Agarwal, C. Patil and O.Katare. (2003) Preparation and pharmacological evaluation of silibinin liposomes. ArzneimitteIforschung 53(6) :420 – 427.
- Mandal, A., S. Das, M. Basu, R. Chakrabarti and N. Das. (2007) Hepatoprotective activity of liposomal flavonoid against arsenite-induced liver fibrosis. The Journal of Pharmacology and Experimental Therapeutics 320(3):994-1001.
- Mastellone, I., E. Polichetti, S. Gres, C. de la Maisonneuve, N. Domingo, V. Marin, A. Lorec, C. Farnarier, H. Portugal, G. Kaplanski, F. Chanussot. (2000) Dietary soybean phosphatidylcholines Iower lipidemia: mechanisms at the levels of intestine, endothelial cell, and hepato-biliary axis. The Journal of Nutritional Biochemistry 77(9) :467- 466.
- Meister, A. (1994) Glutathione-ascorbic acid antioxidant system in animals. The Journal of Biological Chemistry 269(13):9397-9400.
- N., M. Babaei, A, Vali, F. Daha, F. Kobarfard, and S. Dadashzadeh. (2008) 99mTc-HMPAO-labeled liposomes: an investigation into the effects of some formulation factors on labeling efficiency and in vitro stability. Nuclear Medicine and Biology 35(3):387-392,
- Misra A1, Jinturkar K, Patel D, Lalani J, Chougule M. (2009) Recent advances in liposomal dry powder formulations: preparation and evaluation. Expert Opin Drug Deliv; 6(1):71-89. doi: 10.1517/17425240802652309 .
- Nakae, D., K. Yamamoto, H. Yoshiji, T. Kinugasa, H. Maruyama, J. Farber and Y. Konishi. (1990) Liposome-encapsulated superoxide dismutase prevents liver necrosis induced by acetaminophen. American Journal of PathoIogy 136(4) :7 87 -7 95.
- Pintea, A., H. Diehl, C. Momeu, L. Aberle and C. Socaciu, (2005) Incorporation of carotenoid esters into liposomes. Biophysical Chemistry 778(l) :7 -74.
- Puisieux, F., E. Fattal, M. Lahiani, J. Auger, P. Jouannet, P. Couvreur and J. Delattre. (1994) Liposomes, an interesting tool to deliver a bioenergetic substrate (ATP). In vitro and in vivo studies. Journal of Drug Targeting 2(5):443-448.
- Puskas, F., P. Gergely, Jr., K. Banki, and A. Perl. (2000) Stimulation of the pentose phosphate pathway and glutathione levels by dehydroascorbate, the oxldized form of vitamin C. The FASEB Journal 14(10): 1352-1361.
- Rawat, A., B. Vaidya, K. Khatri, A, Goyal, P. Gupta, S. Mahor, R. Paliwal, S. Rai, and S. Vyas. (2007) Targeted intracellular delivery of therapeutics: an overview. Die Pharmazie 62(9):6a3-658.
- Rosenblat, M., N. Volkova, R. Coleman, and M. Aviram. (2007) Antioxidant and anti-atherogenic properties of liposomal glutathione: studies in vitro, and in the atherosclerotic apolipoprotein E-deficient mice. Atherosclerosis 195(2):e61-e68.
- Sarkar, S. and N. Das. (2006) Mannosylated liposomal flavonoid in combating age-related ischemia-reperfusion induced oxidative damage in rat brain. Mechanisms of Ageing and Development 727(4):391-397.
- Sato, Y., K. Murase, J. Kato, M. Kobune, T. Sato, Y. Kawano, R. Takimoto, K. Takada, K. Miyanishi, T. Matsunaga, T.Takayama and Y. Niitsu. (2008) Resolution of liver cirrhosis using vitamin A-coupled liposomes to deliver siRNA against a collagen-specific chaperone. Nature Biotechnology 26(4):431-442.
- Schnyder, A. and l. Huwyler. (2005) Drug transport to brain with targeted liposomes. NeuroRx: The lournal of the American Society for Experimental NeuroTherapeutics 2(L):99-707.
- Sinha J, Das N, Basu MK (2001): Liposomal antioxidants in combating ischemia-reperfusion injury in rat brain; Biomedicine and Pharmacotherapy 55(5):264-271
- Sinha R, Sinha I, Calcagnotto A, Trushin N, Haley JS, Schell TD, Richie JP Jr. (2018) Oral supplementation with liposomal glutathione elevates body stores of glutathione and markers of immune function. Eur J Clin Nutr ;72(1):105-111. doi: 10.1038/ejcn.2017.132. Epub 2017 Aug 30. PMID: 28853742
- Socaciu, C., P. Bojarski, L. Aberle, and H. Diehl. (2002) Different ways to insert carotenoids into liposomes affect structure and dynamics of the bilayer differently. Biophysical Chemistry 99(1):1-15.
- Verma, D., T. Levchenko, E. Bernstein, and V. Torchilin. (2005) ATPloaded liposomes effectively protect mechanical functions of the myocardium from global ischemia in an isolated rat heart model. Journal of Controlled Release 108(2-3):460-477.
- Verma, D., W, Hartner, V. Thakkar, T. Levchenko and V. Torchilin. (2007) Protective effect of coenzyme Q10-loaded liposomes on the myocardium in rabbits with an acute experimental myocardial infarction. Pharmaceutical Research 24(17) :273t-2737.
- Walde, P., A. Giuliani, C. Boicelli, and P. Luisi. (1990) Phospholipidbased reverse micelles. Chemistry and Physics of Lipids 53(4):265-28B.
- Walde, P. and S. Ichikawa. (2001) Enzymes inside lipid vesicles: preparation, reactivity and applications. Biomolecular Engineering t8(4):743-177.
- Waters, R., L. White, and J. May, (1997) Liposomes containing alpha tocopherol and ascorbate are protected from an external oxidant stress. Free Radical Research 26(4):373-379.
- Wendel, A. (1983) Hepatic lipid peroxidation: caused by acute drug intoxication, prevented by liposomal glutathione. International Journal of Clinical Pharmacology Research 3(6):443-447.
- Wilson, J. (2005) Regulation of vitamin C transport. Annual Review of Nutrition 25:105-125.
- Wu, J. and M. Zern. (1999) NF-kappa B, liposomes and pathogenesis of hepatic injury and fibrosis. Frontiers in Bioscience 4:D520-D527.
- Xi, J. and R. Guo. (2007) Interactions between flavonoids and haemoglobin in lecithin liposomes. International Journal of Biological Macromolecules 40(4):305-31 1.
- Yamada, Y. and H. Harashima. (2008) Mitochondrial drug delivery systems for macromolecule and their therapeutic application to mitochondrial diseases. Advanced Drug Delivery Reviews 60(13-14):1439-1462.
- Yao, T., S. Esposti, L. Huang, R. Arnon, A. Spangenberger, and M. Zern. (1994) Inhibition of carbon tetrachloride-induced liver injury by liposomes containing vitamin E. The American Journal of Physiology 267(3 Pt1):G476-G484.
- Yoshimoto, M., Y. Miyazaki, Y. Kudo, K. Fukunaga and K. Nakao. (2006) Glucose oxidation catalysed by liposomal glucose oxidase in the presence of catalase-containing liposomes. Biotechnology Progress 22(3):704-709.
.png)
.png)